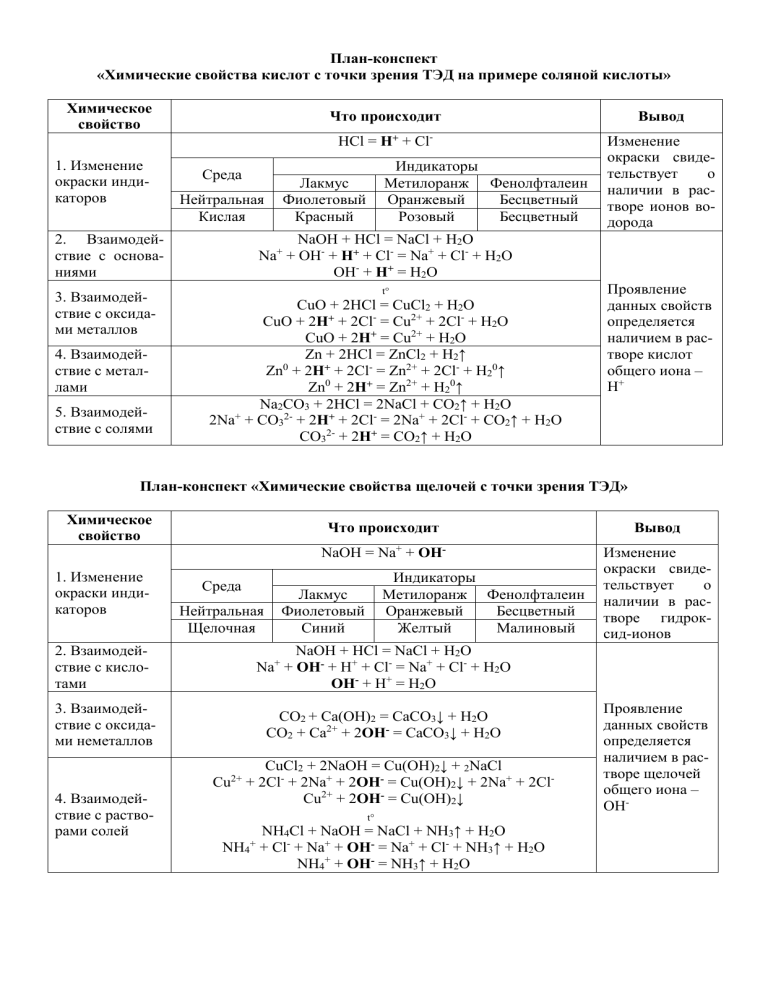
План-конспект
«Химические свойства кислот с точки зрения ТЭД на примере соляной кислоты»
Химическое
свойство
1. Изменение
окраски индикаторов
Среда
3. Взаимодействие с оксидами металлов
4. Взаимодействие с металлами
5. Взаимодействие с солями
Вывод
HCl = H+ + Cl-
Изменение
окраски свидетельствует
о
наличии в растворе ионов водорода
Индикаторы
Метилоранж Фенолфталеин
Оранжевый
Бесцветный
Розовый
Бесцветный
Лакмус
Фиолетовый
Красный
Нейтральная
Кислая
2. Взаимодействие с основаниями
Что происходит
NaOH + HCl = NaCl + H2O
Na + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O
+
t°
CuO + 2HCl = CuCl2 + H2O
CuO + 2H+ + 2Cl- = Cu2+ + 2Cl- + H2O
CuO + 2H+ = Cu2+ + H2O
Zn + 2HCl = ZnCl2 + H2↑
Zn0 + 2H+ + 2Cl- = Zn2+ + 2Cl- + H20↑
Zn0 + 2H+ = Zn2+ + H20↑
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
Проявление
данных свойств
определяется
наличием в растворе кислот
общего иона –
Н+
План-конспект «Химические свойства щелочей с точки зрения ТЭД»
Химическое
свойство
1. Изменение
окраски индикаторов
Среда
Что происходит
Вывод
NaOH = Na+ + OH-
Изменение
окраски свидетельствует
о
наличии в растворе гидроксид-ионов
Индикаторы
Метилоранж Фенолфталеин
Оранжевый
Бесцветный
Желтый
Малиновый
Лакмус
Фиолетовый
Синий
Нейтральная
Щелочная
2. Взаимодействие с кислотами
NaOH + HCl = NaCl + H2O
Na + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O
3. Взаимодействие с оксидами неметаллов
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
4. Взаимодействие с растворами солей
+
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl- + 2Na+ + 2OH- = Cu(OH)2↓ + 2Na+ + 2ClCu2+ + 2OH- = Cu(OH)2↓
t°
NH4Cl + NaOH = NaCl + NH3↑ + H2O
+
NH4 + Cl- + Na+ + OH- = Na+ + Cl- + NH3↑ + H2O
NH4+ + OH- = NH3↑ + H2O
Проявление
данных свойств
определяется
наличием в растворе щелочей
общего иона –
ОН-
План-конспект «Химические свойства средних солей с точки зрения ТЭД»
Химическое
свойство
1. Диссоциация
2. Взаимодействие
с металлами
3. Взаимодействие
со щелочами
4. Взаимодействие
с кислотами
5. Взаимодействие
солей друг с другом
Уравнение химической реакции
Вывод
NaCl ↔ Na+ + ClFeSO4 ↔ Fe2+ + SO42-
Ионный состав раствора зависит от состава соли
Cu + FeSO4 ≠
Fe + CuSO4 = FeSO4 + Cu
Fe0 + Cu2+ + SO42- = Fe2+ + SO42- + Cu0
Fe0 + Cu2+ = Fe2+ + Cu0
NaOH + KCl ≠
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
2Na+ + 2OH- + Cu2+ + 2Cl- = Cu(OH)2↓ + 2Na+ + 2Cl2OH- + Cu2+ = Cu(OH)2↓
H2SiO3 + Na2SO4 ≠
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓
2H+ + SO42- + 2Na+ + SiO32- = 2Na+ + SO42- + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
NaCl + KNO3 ≠
NaCl + AgNO3 = AgCl↓ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ + NO3Cl- + Ag+ = AgCl↓
Соль должна быть
образована менее активным металлом
Хотя бы один из продуктов реакции является нерастворимым
Соль должна быть
образована более слабой кислотой
Хотя бы один из продуктов реакции является нерастворимым
